2022. 5. 8. 21:45ㆍ2020-적층세라믹콘덴서의 재료-제조-실장기술과 최신기술
제2장 MLCC의 구조/재료
제2절 유전체 세라믹스
제2항 티탄산 바륨의 합성법(1)-고상합성
1. MLCC의 원재료로 요구되는 티타늄산 바륨 분체 물성
최근의 전자기기의 소형화 고성능화의 진전에 따라 MLCC도 소형화 고용량화가 강하게 요구되어 현재는 유전체층의 두께는 1um 이하까지 박층화가 진행되고 있다. 박층화를 달성하기 위해서는 유전체 재료인 티타늄산바륨(BaTiO3)에는 입도 분포가 샤프할 것, 응집성이 약하고, 분산성이 좋을 것, 미립자(평균 입경이 200nm 이하), 결정성(정방정성)이 높을 것, 단일상이고 고순도일 것 등의 분체 특성이 요구된다.
BaTiO3의 합성 방법에는 고상법과 액상법인 수열법, 졸겔법, 옥산법 등이 있다. 일반적으로 입도 분포가 사프한 미립자를 합성하려면 액상법이 유리하고 고상법은 프로세스는 저렴하여 대량생산에는 적합하지만 미립자를 얻기에는 부적합하다고 알려져 왔다. 그러나 최근의 TiO2, BaCO3 원재료의 고순도화·미세화나 혼합분산·열처리 프로세스 기술의 진전에 의해 고상법에서도 액상법에 필적하는 분체특성의 BaTiO3를 얻을 수 있게 되었다. 본 항에서는 고상법의 반응과정과 얻어지는 BaTiO3의 분체특성의 관계, 나아가 반응을 촉진하기 위한 각종 기술에 대해 소개한다.
2. BaCO3와 TiO2의 고상반응 과정
BaTiO3 고상합성의 반응 과정은 지금까지 다수 보고되었으며, BaCO3와 TiO2의 등 몰 혼합물의 반응은 다음과 같은 식(1)~(3)으로 진행하는 것으로 알려져 있다.
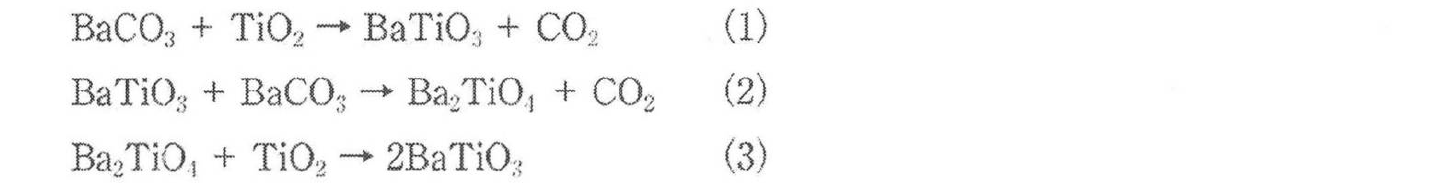
반응 초기에는 식(1)에 의해 TiO2 입자 표면에서 BaTiO3가 생성한다. TiO2 입자 표면을 BaTiO3가 덮으면 식(2)에 따라 Ba2TiO4가 생성하고 BaCO3가 소비된다. 최종적으로 식 (3)에 따라 TiO2 내부까지 Ba가 확산되어 BaTiO3가 생성하는 것으로 알려져 있다. 따라서 반응은 Ba이온종의 TiO2로의 일방 확산으로 진행되며, 생성한 BaTiO3 입자 지름은 출발 원료인 TiO2 입자 크기를 반영하는 것으로 알려져 있다.
그러나 원자재의 미립화가 진행되어 2000년경부터 이 반응 과정의 해석에는 약간의 변화를 보이고 있다. Fujikawa 등은 서브미크론 크기의 BaCO3, TiO2 입자의 고상 반응 과정에서의 미세 구조를 STEM-EDS에 의해 관찰하였다. 식(1)에서는 미세한 BaTiO3 입자가 TiO2 입자 표면을 덮는 듯 생성하고 있으며, 식 (3)의 Ba2TiO4가 TiO2 표면 위를 덮는 모습은 보이지 않는다. 반응이 진행되면 TiO2 입자는 표면에서 내부를 향해 소비되고, 입자 내부까지 BaTiO3로 변화한다. Ba2TiO4는 850℃ 이상에서 Ba 공급이 과다하게 되는 BaCO3가 크게 편석한 곳에서 생성했다고 말하고 있다.
로티크들은 TiO2 단결정 박막상으로 BaCO3를 석출시켜 대기 중 가열 시 생성상과 TiO2의 배향관계에서 반응과정을 조사하였다. BaCO3가 BaO와 CO2로 분해하지 않고 BaCO3와 TiO2는 직접 반응하고 TiO2로 Ba인이 확산됨으로써 BaTiO3가 생성하며 중간생성상인 Ba2TiO4는 BaCO3로 Ti가 확산됨으로써 생성한다. 또한 대기 중에서는 반응 초기의 생성상은 BaTiO3뿐이며, BaTiO3핵이 장벽이 되어 Ba2TiO4는 생성하지 않는다고도 말하고 있다.
BaCO3, TiO2 입자 간의 반응에서도 Buscaglia 등은 대기 중 800°C 이하에서는BaCO3와 TiO2가 직접 반응하고 BaTiO3가 생성한다고 한다. Kobayashi들은 200nm의 BaCO3와 100nm의 루틸 TiO2 혼합 분말을 600℃에서 800℃로 가열하고 TiO2 입자 표면상에 생성한 BaTiO3를 고분해능 TEM으로 해석하였다. TiO2 표면상에 Topotaxial하게 BaTiO3 미결정이 생성되었음이 나타냈으며 600℃에 비해 800°C에서는 TiO2 표면상에 생성한 BaTiO3 결정상의 두께가 증가하고 있는 모습을 볼 수 있다. 어느 해석에서도 BaTiO3는 TiO2로 Ba이온이 확산됨으로써 생성하기 때문에 BaTiO3 직경은 TiO2 원료 입경을 반영하는 것에는 변함이 없다.
또한 대기 중의 합성에 있어서, 2차상의 Ba2TiO4 생성을 억제하려면 BaCO3의 편석을 억제하고, 850℃에서 이하에서 반응을 종료시키면 된다는 것을 알 수 있다. 즉, 단상이면서 미세한 BaTiO3를 합성하려면 미세한 원재료를 이용하여 가능한 한 균일하게 혼합하고 Ba 이온종의 확산거리를 단축하여 반응을 촉진시킬 필요가 있다.
3. 출발원료 BaCO3와 TiO2의 균일혼합
통상 세라믹 분말 합성에서 원재료의 분쇄 * 혼합에는 볼밀이나 매체 교반밀 등의 분쇄기나 고에너지 분산기가 이용된다. 볼밀 등을 이용하여 원재료의 혼합을 실시하면 혼합 균일성이나 분산성이 향상될 뿐만 아니라 마찰, 충격과 같은 기계적 에너지에 의해 분체의 물리적 * 화학적 성질이 변화하는 메카노케미컬 효과가 발생한다. 메카노 케미컬 효과를 이용함으로써 통상 단상을 얻기 어렵고 복잡한 다단계 프로세스를 필요로 하는 복합 산화물 합성에 있어서도 목적 생성물을 효율적으로 얻을 수 있다.
BaTiO3 고상 합성에서도 일반적으로 1,000°C 이상의 온도가 필요하다고 알려져 있으나 메카노케미칼 효과를 이용하여 반응 온도를 낮추는 연구도 이루어지고 있다. Kong 등은 BaCO3, TiO2 분말을 φ10mm 텅스텐카바이드 미디어를 이용하여 유성볼밀로 건식분쇄처리하고 800°C 2시간의 열처리로 BaTiO3 단상을 얻고 있다.
BaTiO3 합성온도의 저온화는 에너지 비용의 저감은 물론, 미세하고 저응집성의 입자를 얻기 위해 중요하다. 이에 저온 합성에 유리한 메카노케미컬 효과를 응용하여 공업적인 프로세스를 염두에 둔 미립자 합성을 검토한 예를 소개한다.
미세한 출발원료 BaCO3(장축 약 500nm의 침상입자)와 TiO2(평균지름 50nm)를 이용하여 서로 다른 혼합분산 상태의 샘플 3종(그림1)을 제작하였다. 시료W는 BaCO3와 TiO2등 몰혼합가루를 물을 분산매로 하여 디스퍼로 혼합하여 건조한 것, 시료S는 시료W를 건조 전에 습식 비즈밀 처리를 하여 건조하였으나 시료Sb는 시료S를 추가로 φ10mm 철심이 들어있는 나일론볼로 유성볼밀 처리한 것이다. 그림 1에서 시료 W는 막대 모양의 BaCO3만으로 구성되는 1um을 초과하는 영역과 미세한 입상의 TiO2만으로 구성되는 1um을 초과하는 영역의 혼합 상태였다. 이에 시료 S와 Sb에서는 BaCO3와 TiO2는 거의 일차 입자 수준까지 혼합이 진행됐다. BaCO3 입자 형상은 시료 W, S 모두 바늘 모양이었으나 시료 Sb에서는 등축인 구형과 가까운 형상까지 마모·분쇄가 진행되었다.

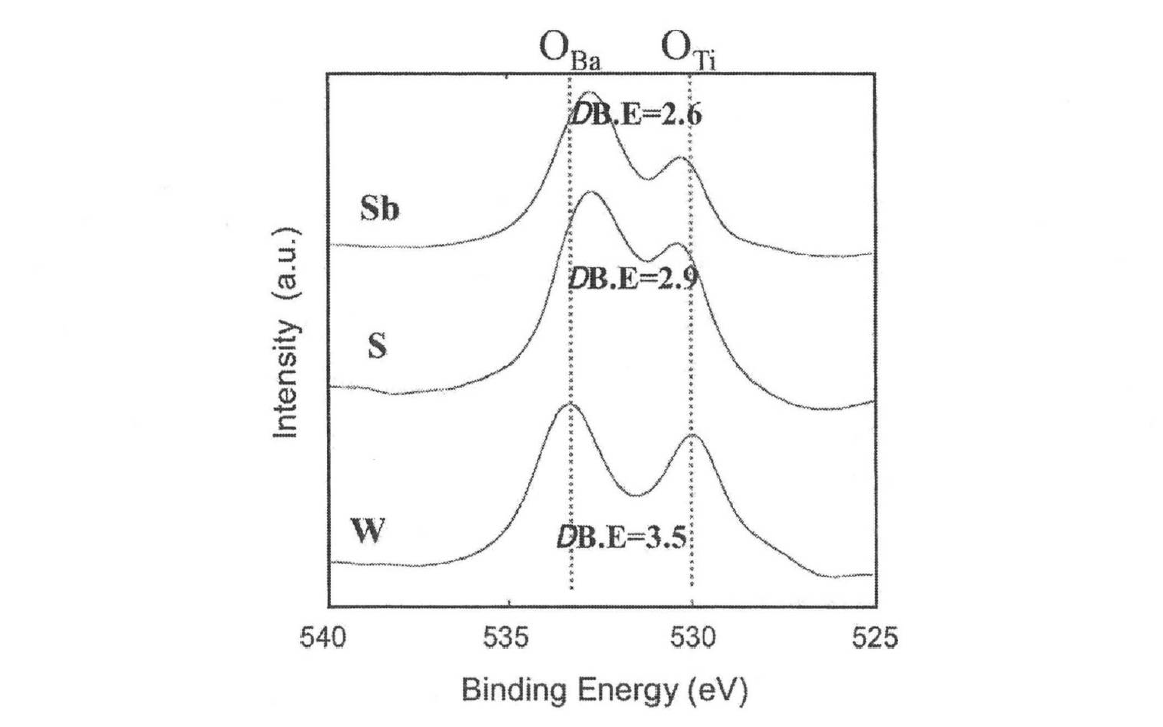
혼합 분산 처리에 의한 메카노 케미컬 변화에 대해 조사하였다. 그림 2는 혼합 시료의 분체 표면의 화학 상태를 XPS로 측정한 결과이다. 시료 W 대비 혼합 분산 처리를 진행한 시료 S, Sb는 BaCO3와 TiO2에서 유래한 2개의 O1s 피크가 서로 가까워졌다. Ba-0-Ti 결합에 가까운 전구체가 생성한 것으로 생각된다. Ba-0-Ti 전구체의 생성은 TiO2로의 Ba이온의 확산을 용이하게 하고, BaTiO3 합성 반응을 촉진한다고 생각된다.
혼합 분산 처리가 합성 반응에 미치는 영향을 조사했다. 그림 3에는 TG 곡선과 DTG 곡선을 나타낸다. 그림 3에서 관찰되는 중량 감소는 식(1) 혹은 (2) 중 어느 하나의 반응에 의해 BaCO3에서 CO2가 탈리된 것에 의한다. 그림 3b)의 미분 곡선에서 반응은 단계에서 진행하는 모습이 관찰되었다.
시료 W는 500℃ 후반부터 감량이 시작되어 830℃ 부근에서 중량 감소가 활발해져 반응이 2단으로 나뉘는 모습은 불분명했다. 시료 S에서는 580℃와 820℃에서의 2단으로 나뉘고 시료 Sb에서는 550℃와 710℃에서의 2단으로 나뉘어 진행했다. 시료 S 쪽이 시료 W에 비해 저온측의 1단계 반응량이 많았다. 이는 그림 1의 SEM 상에서도 밝혀진 바와 같이 습식 비즈밀에 의해 BaCO3와 TiO2의 접점수가 증대되었음을 나타낸다.
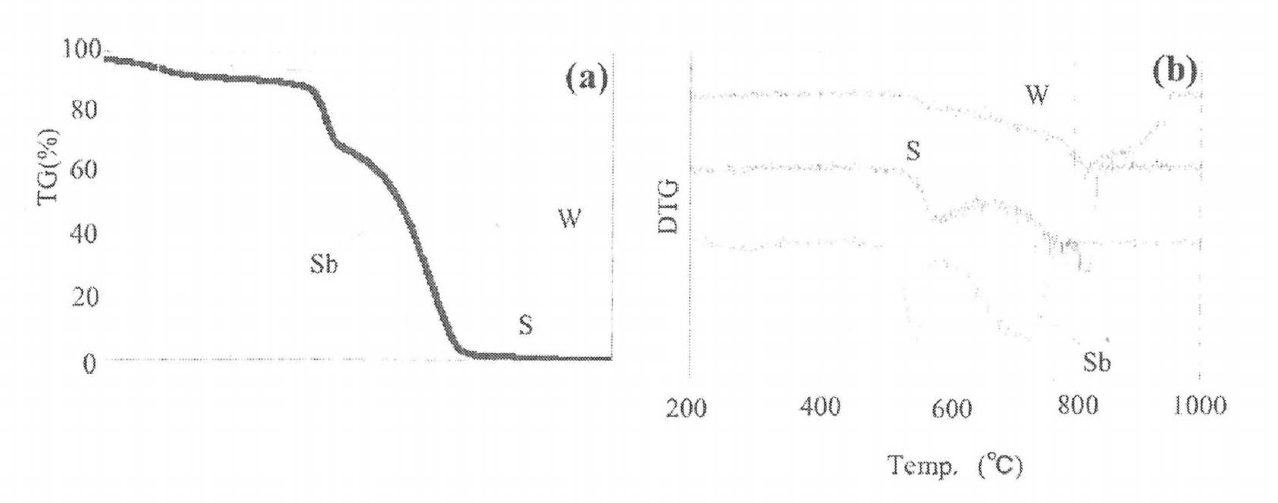
게다가 시료 Sb는 시료 S에 비해 혼합 균일성이 향상되었으며 TG에서도 초기 반응량의 대폭적인 증대를 볼 수 있었다.
반면 고온 측 2단계 반응은, 잔존하고 있는 TiO2와 BaCO3의 반응이다. 시료 W와 같이 혼합 균일성이 나쁜 경우는 BaCO3-TiO2 계면이 적기 때문에 저온측의 반응량이 적다. 그리고 TiO2 입자만 BaCO3 입자만으로 수 jim의 응집체를 형성하고 있으므로 Ba 이온종의 확산도 TiO2 응집 입자 전체에 걸쳐 일어날 필요가 있으며 확산 거리는 커지게 된다. 이 때문에 반응 종료가 고온화 될 것으로 생각된다. 시료 Sb에서는 저온측의 1단계 반응은 시료 W, S에 비해 약 30℃ 저온에서 시작하여 DTG 곡선으로부터 1단 반응량의 증가도 확인되었다. 또 시료 W, S 대비 감량 종료도 저온화돼 반응성이 향상됐다.
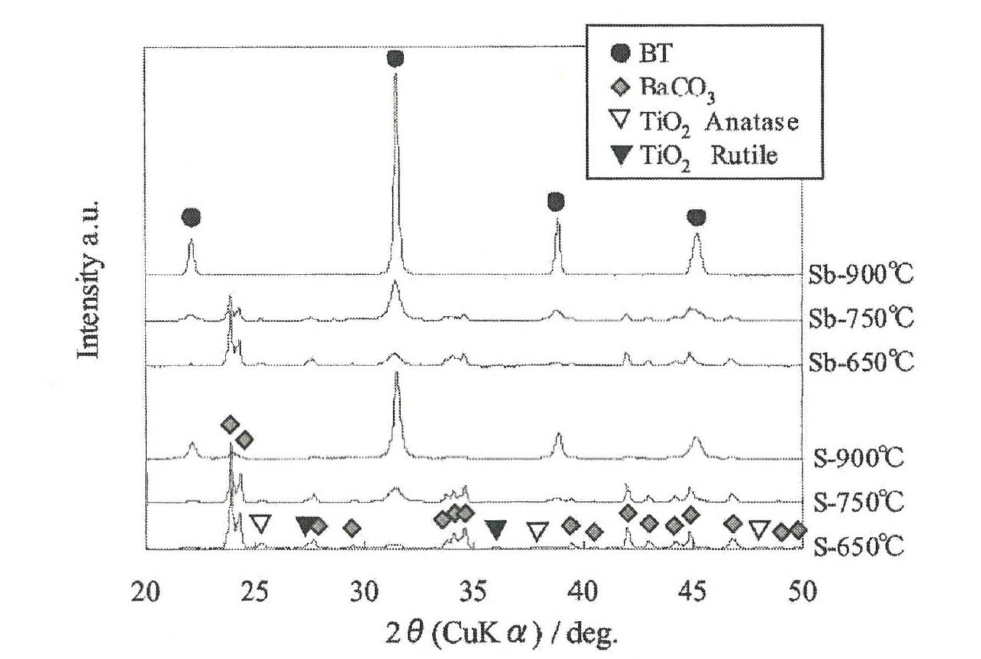
DTG에서 볼 수 있었던 각 반응단계가 어떤 반응식에 대응하는지를 고찰하기 위해 시료 S, Sb를 가열 급랭하여 분말 XRD 측정 및 TEM 관찰을 실시하였다. 그림4의 XRD 프로파일에서 시료 S에 비해 Sb가 BaCO3 감소와 BaTiO3 생성이 보다 저온에서 일어나는 것으로 나타났으며 그림3의 TG 측정결과와도 경향이 일치했다. 시료 Sb에서는 900℃에서 BaTiO3 단상을 얻어져, 피크강도도 크고 결정성장도 진행되어 있었다.
시료 Sb의 650°C와 시료 S의 750°C가 거의 BaTiO3의 생성량이 동등했다.이 두 샘플을 TEM에서 관찰하였다. 그림 5의 TEM 상에서는 시료 S의 750°C, Sb의 650°C와도 거의 동일한 형태를 보였으며 0.1um 이상의 큰 BaCO3 입자와 10~30nm의 BaTiO3 초미립자가 50~80nm의 응집체를 형성하고 있는 모습이 관찰되었다. 이 결과는 앞서 언급한 Fujikawa 등의 보고와도 잘 일치한다.
이상에서 그림3의 열분석 결과와 그림5의 TEM상과 함께 생각할 때 중량감소의 제1단은 식에 따라 TiO2 표면상에 BaTiO3 초미립자가 생성하는 과정이라는 것을 알 수 있었다. 시료 Sb와 같이 혼합 균일성이 높은 경우에 대해서 그림3의 열분석 결과나 그림 5의 TEM 상에서 반응 메커니즘을 고찰하고 그림 6(a)에 모식도를 나타낸다. 1단계 반응은 식(1)에 따라 TiO2 표면 상에 BaTiO3 입자가 생성하는 과정이다.

2단계 반응은 1단 반응에 의해 생성한 BaTiO3 나노입자 하부에 존재하는 TiO2로 Ba 이온종이 확산되는 과정이다. 이때 2단계 반응 개시~종료가 850℃보다 낮고 그림 4에서도 Ba2TiO4는 관측되지 않았다. 따라서 시료 Sb의 2단계 반응은 앞서 설명한 보고도 고려할 때 Ba2TiO4는 관여하지 않고 식(1)에 따라 진행되고 있다고 생각된다.그림 6(b)에는 혼합이 불충분한 경우의 반응 모식도도 나타냈다.

시료 W, S, Sb를 1000℃에서 2시간 동안 열처리하고 SEM 관찰을 실시했다. 그림 7의 SEM 상에서는 시료 W는 부정형의 입자가 많고 입자 지름도 고르지 않았으며 시료 S도 구형이나 각진 형상이 혼재하고 입자 지름도 고르지 않았다. 한편 시료 Sb는 형상이나 입자 지름이 균일했다. 각각 분말XRD 측정 결과로부터 c축과 a축 길이의 비(c/a)를 산출했는데, 시료 W와 S는 1.0078이었던 반면 시료 Sb는 1.0095로 높은 정방정성을 보였다.
분산, 혼합 처리에 의한 메카노 케미컬 반응에 의해 고상 반응 활성이 향상되었다. 더욱이 건식볼밀처리로 원재료입자의 분쇄가 일어나면서 혼합균일성도 높아져 해리된 Ba이온종은 쉽게 TiO2와 만날 수 있었고, 그 결과, 보다 저온에서 BaTiO3핵을 다량 균일하게 생성시킬 수 있게 된 것이 입도분포가 협소한 BaTiO3입자합성으로 이어졌다고 생각된다.

4.고상반응 촉진과 미립자 BaTiO3 합성
C=O, >N-H기를 포함한 유기물의 첨가에 의해 BaCO3 분해반응온도가 저하되는 것으로 나타났다. BaCO3에 흡착한 글리신 등 C=0, > N-H를 겸비한 화합물에는 Ba-CO3간의 결합을 느슨하게 하는 효과가 있음을 확인하였다. 우혈청 알부민(BSA)을 이용한 경우에도 동일한 반응촉진 효과가 확인되었다. 원재료의 혼합 프로세스로는 대량생산을 고려할 때 수계의 습식분산이 유리하므로 습식분산시 유기화합물을 첨가하는 방법으로 반응촉진 효과를 얻을 수 있다면 유용하다. 더욱이 고분자화합물을 이용하여 열처리시 카본을 잔류시키고 BaTiO3의 입자성장을 억제하고 미립자를 합성할 수 있다.
단, 카본 잔류에 의한 국소적인 환원 분위기에 의한 산소 결함 생성이 정방정성의 저하를 일으키기 때문에 적절한 산소 분압으로 합성을 실시할 필요가 있다. 이러한 검토에 의해 그림 8과 같이 평균 입경 120nm로 미세하고 입도 분포가 좁아 고정방정성의 BaTiO3를 얻을 수 있었다.

전술한 습식 비즈밀, 건식 볼밀 처리에 의한 메카노케미컬 효과도 고상반응 촉진에 기여하고 있다. 그러나 과도한 메카노케미칼 반응은 입자끼리 견고하게 응집시키거나 결정성장을 저해하는 등 역효과를 내는 것도 확인되었으며 그림 6(a)의 반응모델에서 BaCO3와 TiO2의 접점수를 늘려 Ba 이온종의 확산거리를 줄이는, 즉 미세한 원재료를 최대한 균일하게 혼합함으로써 미세한 BaTiO3가 합성될 수 있음을 알 수 있다.
그래서 그림 9에 나타내는 초미립자 원료를 이용해 메카니컬 스트레스를 최대한 억제하면서 균일한 혼합물을 제작했는데, 650°C까지 반응 종료하는 것이 확인되었으며, 또한 800°C의 열처리로 그림 10과 같이 평균 입경 40nm로 미세하고 입도 분포가 샤프한 단상 BaTiO3 미립자를 얻을 수 있었다.

원료 혼합 균일성, 메카노케미칼 효과, 유기물 첨가 등과 반응 과정에 영향을 미치는 인자를 조합함으로써 고상합성으로도 수십 nm 수준의 미세한 BaTiO3 입자가 합성될 수 있게 되었다. 미립자 티타늄산 바륨을 저비용으로 생산할 수 있는 고상합성은 향후 MLCC의 추가적인 소형 대용량화와 생산수량 증대를 뒷받침하는 중요한 기술이다.

참고문헌

'2020-적층세라믹콘덴서의 재료-제조-실장기술과 최신기술' 카테고리의 다른 글
| 제2장3절 내부전극용 Ni분말의 제조법(1항CVD법) (0) | 2022.05.16 |
|---|---|
| 제2장2절-3 티탄산바륨의 합성법(2) - 수열합성 (0) | 2022.05.15 |
| 제2장2절-1 티탄산 바륨의 원료-산화티탄 (0) | 2022.05.07 |
| 제2장1절 구조와 재료 (0) | 2022.05.07 |
| 제1장4절 소형화 박층화 다층화 (0) | 2022.05.02 |