| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
- paste
- Sintering
- hydrothermal
- Powder
- core-shell
- CERAMIC
- nickel
- mlcc
- CSZT
- halt
- dispersion
- X8R
- ni-paste
- Zirconia
- C0G
- X7T
- Automotive
- ASSB
- coating
- ZrO2
- Barium titanate
- microstructure
- EV
- nano powder
- NI-MLCC
- oxygen vacancy
- reliability
- bme
- Murata
- BaTiO3
- Today
- Total
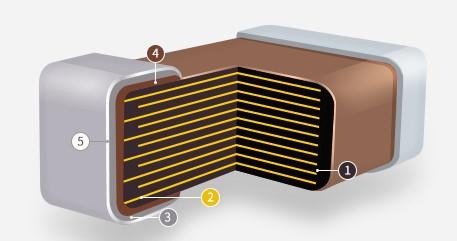
MLCC Material & Process
(Powder Synthesis)수열법에 의한 세라믹 분말의 합성 본문
니치아스 기술연보 (2008) 2호
高知大学 理学部附属水熱化学実験所 教授 柳澤和道
1. 서론
수열 반응은 100℃, 1기압 이상의 고온 고압하의 물이 관여하는 반응으로서 정의되어 있다.이 때문에 수열반응을 실시하기 위해서는 통상 오토 클레이브라 불리는 고온고압용기가 필요하다.한편, 물의 성질은 온도 변화와 함께 연속적으로 변화하므로, 99℃와 101℃에서의 반응은 본질적으로 큰 차이는 없다. 따라서 정의와는 별도로 수열 반응은 실온에서의 반응을 포함해 물이 관여하는 모든 반응을 포함하는 것이라고 생각할 수 있다. 알코올 등의 유기용매를 사용하는 Solvethermal 반응도, 소량의 물이 관여하고 있는 경우가 많으며, 이 경우에는 Solvethermal 반응도 수열 반응의 일종으로서 생각할 수 있다.
고온 고압하의 물은 실온의 물과는 다른 성질을 가진다. 포화 증기압하의 물의 밀도, 점성, 표면 장력, 유전율은 온도가 상승하면 연속적으로 감소한다. 또, 물의 이온적은 온도 상승에 따라 증가하여 약 270℃에서 극대치를 취한다.이와 같이 고온 고압하의 물은 유기물을 용해하는 성질을 띠는 동시에 이온 반응의 적합한 반응장을 형성하여 이온이나 분자가 확산하기 쉽고 높은 반응속도를 얻을 수 있는 뛰어난 용매가 될 수 있다.이 성질을 이용하여 수열법은 다양한 세라믹 분말의 합성에 이용되고 있다.
2. 수열법의 특징
복산화물등의 세라믹 분말의 합성에는, 고상 반응이 종래부터 이용되어 왔다.고상 반응에서는 두 개 이상의 고체 반응 물질 입자가 서로 접촉하고, 그 접촉점으로부터 이온이 확산하여 반응 물질이 생성한다.반응을 더 진행시키기 위해서는 반응 생성물인 고체 속을 이온이 확산시킬 필요가 있다.이와 같이 고체 내에서의 이온 확산에 의해 반응이 진행되기 위해 1000℃ 정도의 고온을 필요로 하며, 반응을 완결시키기 위해서는 장시간을 필요로 한다.이온이 확산되기 위한 구동력은 농도 경사이기 때문에 반응이 완결되지 않는 경우도 많으며, 고상 반응으로 얻은 생성물의 조성적인 균일성은 낮다.또, 고상 반응에서는 생성물 입자가 응집한 상태로 얻을 수 있기 때문에, 분말로 하기 위해서는 분쇄 공정을 필요로 한다.
이에 비해 많은 수열반응에 의한 세라믹 분말의 생성은 이온의 용해-석출기구에 의해 진행된다.수열반응에서는 반응물질이 약하게 용해되는 것만으로 반응이 진행되기 때문에 극히 저온에서 목적물질을 합성할 수 있다.고체상 반응과 비교해서 수열 반응은 이하의 특징을 가진다.
(1) 수열 조건하에서 안정적인 화합물을 합성할 수 있다.
수화물, 수산화물, 황화물, 탄산염 등은 공기 중에 가열하면 분해되므로 고체반응에서는 합성하는 것이 곤란하지만, 수열반응에서는 비교적 용이하게 합성할 수 있다. 다형이 관찰되는 화합물에서는 저온형 석영인 수정의 단결정 육성에 수열법이 이용되고 있는 것처럼 수열법에서는 저온상을 합성할 수 있다.또한 아나타제와 같은 준안정상의 합성도 가능하다.
(2) 저온에서 단시간의 반응에 의해 분말을 합성할 수 있다.
(3) 분말의 연속 합성이 가능하다.
수열반응에 의한 세라믹 분말의 합성에서는 물을 매체로 하여 분말을 합성하기 위하여 반응물질을 용액이나 슬러리 상태에서 오토클레이브에 압입하여 밸브에 의해 계내의 압력을 유지함으로써 생성물을 수송하면서 합성할 수 있다.실제로 티탄산바륨 분말의 공업적인 수열합성은 연속 수열반응장치를 사용하여 행해지고 있다.
(4) 생성물은 높은 결정성을 가지며 조성적 균일성이 높다.
많은 수열반응은 용해-석출기구에 의해 진행되기 때문에 용액 내에서 핵생성에 이어 결정 성장이 일어난다.그 때문에 얻을 수 있는 생성물은 높은 결정성을 가지며, 하나의 결정 내에서의 조성적 균일성이 높다.
(5) 분말의 직접 합성이 가능하다.
고체상 반응에서는 분쇄, 분급 공정을 필요로 한다.
(6) 고순도 분말을 얻을 수 있다.
고체상 반응에서는 분쇄 공정에서 불순물이 혼입하기 쉽다.
(7) 입자의 크기와 형상 제어가 가능하다.
수열반응에서는 합성조건을 제어함으로써 nm 크기의 미분말에서 cm 크기의 단결정까지, 다양한 크기의 입자를 합성할 수 있다.또 얻을 수 있는 분말 입자는, 생성물의 결정 구조를 반영한 판상이나 바늘상의 자형을 가지는 단결정 입자로서 합성할 수 있으며, 그 형상은 첨가물이나 합성 조건에 의해 제어 가능하다.
3. 수열법에 의한 세라믹 분말의 합성 예시
SciFinder에 의해 hydrothermal-preparation 로 검색을 실시하면, 68000건을 넘는 건수가 히트한다. 이를 연차별로 나타내면 그림 1을 얻는다. 1965년까지는 연간 수십건이었던 것이 1995년에는 600건에 이르렀고, 그 이후 특히 1997년 이후는 가속도적으로 건수가 증가해 2004년에는 연간 2000건을 넘었다. 이 변화는, nano 나 mesoporous 로 검색한 결과와 매우 유사하다.1997년 이후의 가속도적인 수열 합성 연구의 건수의 증가는, 수열 반응이 메소 다공체나 나노 물질의 합성에도 이용되고 있기 때문이라고 생각할 수 있다.본 해설에서는, 수열법의 큰 특징인 분말 입자의 형태 제어에 대해서, 나노 튜브나 메소 다공체의 합성도 포함해 몇 개의 합성예를 소개한다.

3.1 결정 성장에 의한 형상 제어
일반적인 수열법에 의한 세라믹 분말의 합성은 고체 반응 물질과 용매 혹은 반응 물질로서 작용하는 수용액을 오토 클레이브에 넣어 고온 고압 조건하에서 처리함으로써 이루어진다.이 처리를 통해 고체 반응 물질이 용해되어 서로 반응하거나 수용액의 성분과 반응함으로써 반응 물질과는 다른 목적상이 석출된다.이 때, 온도, 수용액의 종류나 농도, pH 등을 변화시킴으로써 얻어지는 생성물의 결정 형상을 제어할 수 있다.이 방법은 탄산칼슘 등 많은 수용액계로부터 공업적으로 생산되는 분말의 입자 형상 제어에 이용되고 있다.
단순한 계로서 수산화나트륨과 질산알루미늄의 수용액을 혼합하여 수열처리함으로써 얻은 베이마이트의 형상에 관해서 소개한다. 그림2에 나타내는 것과 같이 원료의 배합비나 반응온도를 변화시킨 것만으로 얻어진 베이마이트의 형태나 크기가 현저하게 변화하는 것을 알 수 있다.

실리카와 수산화칼슘으로부터의 규산칼슘 수화물의 합성과 같이 반응물질의 용해도가 온도 상승에 의해 역전되고, 또한 계내에 다수의 유사한 화합물이 존재하는 경우, 반응 자체가 매우 복잡하며, 온도가 상승함에 따라 전구체를 경유해서 목적화합물이 생성된다.예를 들어 섬유상으로 결정화하기 위해 그 성형체가 단열재나 인공목재로서 이용되는 조노트라이트(Ca(Si66O17)(OH)2)는 실리카와 수산화칼슘의 슬러리를 수열처리하여 합성되었는데, 그 경우 우선 저온에서는 용해도가 낮은 실리카 입자의 표면에서 칼슘 리치한 C-S-H겔이 접근하여 합성되었는데, 그 경우 우선 저온에서는 용해도가 낮은 실리카트 조반으로 가서 알러지 반응이 일어나며, 미응성된 실리카 입자의 표면에서 칼슘 리치 C-Clite의 반응하여 미응해 질리카와 젤이 만들어지고 있다.이와 같이 전구체를 경유하고 있기 때문에, 조노트라이트는 단시간의 합성이 곤란하고, 또 장섬유화하기 어렵다.그러나 단결정 육성과 같은 원리로, 조노트라이트가 안정된 조건하에서 반응 물질의 이온을 공급함으로써, 장섬유화한 결정으로 이루어지는 조노트라이트 분말를 얻을 수 있다.(그림3)

소프트 화학적 구조 변환 반응을 이용하면, 원료의 분말 입자의 형상을 유지한 채 생성물로 변환할 수 있다. 예를 들면, 플럭스법에 의해 합성한 층상 티타늄산염 K0.8Ti 1.73Li 0.27O4의 판상 결정을 산처리해 이온 교환하면, 입자의 형상을 유지한 채 층상 티타늄산 H1.07Ti1.73Ti1.이 티타늄산을 순수중에서 수열 처리를 실시하면 판상의 아나타아제 결정이 생성하고, 수산화바륨 수용액중에서 수열 처리를 실시하면 판상 결정으로 이루어진 티타늄산바륨을 합성할 수 있다(그림 4). 이 방법은 수열 소프트 화학법이라 불리며, 무기재료의 구조나 형상을 제어할 수 있는 새로운 방법이다.

3.2 나노튜브
이 수년래의 나노재료의 개발에 관한 연구는, 눈부신 발전을 이루어 오고 있다. 나노재료의 합성에 있어서 수열법은 매우 중요한 방법이며, 수열법을 이용하여 나노입자, 나노와이어, 나노로드, 나노벨트, 나노튜브 등 다양한 형태를 가진 세라믹 분말이 합성되어 있다.여기에서는 나노튜브에 초점을 맞추어 수열법의 유용성을 소개한다.
카본나노튜브가 Iijima에 의해 1991년에 발견된 이래 합성뿐만 아니라 그 응용에 관해서도 널리 연구가 실시되고 있다.카본 나노튜브의 합성은 아크방전, 레이저 증발법, CVD법 등 기상을 통한 합성이 일반적이지만, 수열법에 의해서도 합성할 수 있다. 예를 들어 니켈 금속공존 하에서 700-800℃, 60-100MPa에서의 폴리에틸렌 수열처리 800℃, 100MPa에서 비정질 카본의 순수 속에서 수열처리에 의해 카본나노튜브가 합성되었다. 최근에는 저온의 수열조건 하에서도 합성이 보고되고 있어 H3PMo12O40이나 H4SiMo12O40 수용탄 중에서 활성탄을 180℃에서 수열처리 하거나 폴리에틸렌 글리콜을 탄소원으로 하고 무촉매로 160℃의 수열처리에 의해 카본 나노튜브가 합성되고 있다.
최근에는 산화물의 나노튜브 합성도 활발히 이루어지고 있다.티타니아의 나노튜브는 Kasuga등에 의해 처음으로 합성되었다.합성 방법은 매우 간단하며, 티타니아 원료를 5-10N의 수산화나트륨 수용액중에서 110℃, 20시간의 수열 처리 후, 물 혹은 염산으로 생성물을 처리함으로써 외경 8nm, 내경 5nm, 길이 100nm의 중공 침상 결정을 얻을 수 있다.이 방법은 재현성이 있어 쉽게 티타니아 나노튜브를 합성할 수 있다(그림 5). 당초 이 티타니아 나노튜브는 산화티타늄으로 생각되었으나, Chen등은 [001]방향에 따른 H2Ti3O7의 (100) 시트가 튜브의 축방향인 [010]방향으로 병행으로 감아 튜브를 형성하는 생성기구를 나타냈다. 최근에는, H2Ti3O7 보다 오히려 lepidocrocite HxTi2 -x/4□x/4O4(x~0.7, □: 빈 구멍)가 구성 단위인 것이 지적되고 있다. 층상 구조를 가진 δ-NaMnO2를 순수 속에서 수열 처리함으로써 δ-MnO2의 나노 튜브도 합성되어 있는데 이것도 티타니아 나노튜브와 마찬가지로 층상 시트가 감아서 튜브를 형성하는 것으로 생각된다.

이 티타니아의 나노튜브 발견 이후 지금까지 많은 종류의 나노튜브가 수열법에 의해 합성되고 있다.특히 희토류의 수산화물과 산화물 나노튜브의 합성 예가 많다. Xu 등은 Dy2O3를 단순히 순수 속에서 160℃, 48시간의 수열 처리를 실시함으로써 외경이 40~500nm, 내경이 20~300nm, 길이가 1~4μm인 Dy(OH)3의 튜브 모양 결정이 생성되어, 이 결정을 450℃에서 가소함으로써 형상을 유지한 채 Dy2O3로 변환할 수 있다.또 동시에 튜브 형태의 Ho(OH)3와 Ho2O3 결정도 합성했다.동일한 방법으로 Tb(OH)3, Tb2O3, Tb4O7의 나노튜브도 합성되어 있다.수열처리를 실시할 때에 폴리에틸렌 글리콜을 첨가하면, 아스펙트비가 매우 큰 Dy(OH)3 튜브상 결정을 얻을 수 있다고 보고되고 있다.
이 방법은 다른 희토류 수산화물이나 산화물의 합성에도 응용 가능하며 이를테면 Y(OH)3 튜브상 결정이 질산 이트륨, 수산화 나트륨, 폴리에틸렌 글리콜의 혼합 용액을 수열 처리함으로써 합성되고 있다. 이 희토류 수산화물의 튜브 모양 결정은 벽의 두께가 매우 두꺼운 것이 특징이다.최근에 와서 단층 혹은 2층의 아주 얇은 벽을 가진다. Yb(OH)3 나노튜브상결정이 Yada등 19)에 의해 합성되었다.질산염을 원료로 황산나트륨을 첨가하는 것이 이 방법의 특징으로, 80℃, 40시간 처리에 의해 지름이 10~30nm이고 길이가 수백 nm인 나노튜브가 생성된다.또 합성시에 methyl methacrylate(MMA)를 첨가함으로써 표면에 MMA가 결합한 Y(OH)3 나노튜브도 합성되어 있다. 。
촉매로서 중요한 바나듐 산화물의 나노튜브도, 산화물에 아민류를 첨가해 우선 겔을 합성해, 그 겔을 수열 처리하는 것으로 합성되고 있다.BaTiO3와 SrTiO3의 펠로브스카이트 산화물 다결정체 나노튜브도, 티타니아 나노튜브를 원료로 하는 것으로 합성할 수 있다. Mao 등은 Kasuga 등의 방법을 이용하여 합성한 티타니아 나노튜브를, pH를 10에서 12로 조정한 Ba 혹은 Sr수용액중에서 환류함으로써 BaTiO3와 SrTiO3 나노튜브를 합성하고 있다. 또, Padture 등은 티타늄 금속을 양극 산화해서 티타니아 나노튜브가 배열한 박막을 합성해, 수산화바륨 수용액중에서 200℃의 수열 처리를 실시하는 것으로 티타늄 금속 기판상으로 배열한 BaTiO3 나노튜브 박막을 합성했다.
황화물로서는 MoS2와 WS2의 나노튜브가 합성되어 있다. MoS2 나노튜브 는 MoO3와 KSCN과의 180℃에서의 수열반응에 의해 다결정체로 생성되어 WS2 나노튜브 파수열법으로 합성한 WO3 나노로드를 840℃에서 H2S로 환원시킴으로써 얻을 수 있다.금속 나노튜브도 수용액계의 반응을 이용해 합성할 수 있다. Te나노튜브 하이텔루산의 에틸렌글리콜 환원, Bi나노튜브 는 질산염의 히드라진에 의한 120℃에서의 환원에 의해 합성되어 있다. Cu 나노튜브 는 Cu(OH)4 2 -수용액에 표면활성제를 첨가한 후 히드라진 혹은 글루코스에 의해 실온으로 환원함으로써 얻을 수 있으며, 수열조건 하에서의 반응에서는 CuO나노튜브가 생성된다. Se나노튜브 파수열법에 의해 일단 금속을 용해시킨 후에 히드라진으로 구상금속입자를 석출시키고, 그것을 초음파처리함으로써 합성되었다.
3.3 메소폴라스실리카
메소폴러스 물질은 세공경~50nm의 메소공을 가지는 다공질 물질을 의미하며, 그 합성의 기본 컨셉은 유기 분자 집합체를 주형으로 하여 무기 구성 성분과의 무기 유기 메소 구조체의 합성과 그에 이은 주형의 제거에 의한 메소공의 생성에 있다.이 무기 유기 메소 구조체의 합성에 수열법이 이용되고 있다.최초의 메소폴라스실리카는 층상 규산염 카네마이트와 알킬트리메틸암모늄 이온과의 60℃의 수용액 중에서의 반응에 의해 합성된 생성물을 700℃에서 소성함으로써 얻을 수 있었다.균일한 세공이 육방정계에 규칙적으로 배열한 MCM-은 Mobil사의 연구 그룹에 의해 표면활성제의 공존 하에서 150℃의 수열처리에 의해 얻은 규산알루미늄겔을 540℃에서 가소함으로써 합성되었다.1992년의 이 발견의 발표 이래, 메소폴라스실리카의 조성, 구조, 표면 수식 등 합성에 관한 것 뿐만이 아니라, 응용에 관해서도 넓게 연구가 실시되고 있다.그 내용은 다른 서적에 자세하게 소개되어 있으므로 참조하기 바란다.
4. 끝으로
수열법은 수정의 단결정 육성, 규산칼슘계 건축재료나 티탄산바륨분말의 생산 등 이미 공업적으로 널리 이용되고 있는 세라믹의 합성기술이다.수열법에 의한 세라믹 분말의 합성에 관해서는, 지금까지 소결성이 높은 분말을 합성하는 것에 주로 흥미가 놓여져 있었지만, 수열법에 의한 분말 합성은 얻을 수 있는 입자의 형상이나 크기를 제어할 수 있다는 특징을 가지고 있어 최근에는 수열법에 의한 입자 형태의 제어도 주목받고 있다.섬유상이나 판상 등의 분말 입자의 형상 자체가 부가가치를 가지고 있어, 종래의 제품에서도 수열 반응의 공정을 궁리하는 것만으로, 분말의 형상이나 크기를 제어할 수 있어 종래품을 고부가가치화할 수 있다.더욱이 최근의 나노 사이언스의 눈부신 발전과 함께, 물이 개재하는 반응장은 유기-무기 복합체의 합성에는 빠뜨릴 수 없기 때문에, 수열법은 나노 재료의 합성 기술로서 넓게 이용되게 되었다.수열반응은 기존 재료의 고품질화뿐만 아니라 신재료의 개발을 위해 앞으로도 널리 이용될 것이다.
参考文献
1) 柳澤和道,具志大介,恩田歩武,梶芳浩二,“無機マテリアル学会第109回学術講演会予稿集”,(2004)p.78.
2) K.Yanagisawa, Q. Feng, N. Yamasaki, J. Mater. Sci.Letters, 16, 889 (1997).
3) Q. Feng, K.Yanagisawa, J. Soc. Inorg. Mater., Japan., 8, 469 (2001).
4) S. Iijima, Nature, 354, 56 (1991).
5) Y. Gogotsi, J. A. Libera, M. Yoshimura, J Mater Res 15 2591 (2000).
6) J. M. Moreno, M. Yoshimura, J. Am. Chem. Soc., 123, 741 (2001).
7) Z. Kang, E. Wang, B. Mao, Z. Su, L. S. Gao, Lei, L. Xu,J. Am. Chem. Soc., 127, 6534 (2005).
8) W. Wang, J. Y. Huang, D. Z. Wang, Z. F. Ren,Carbon, 43, 1328 (2005).
9) T. Kasuga, M. Hiramatsu, A. Hoson, T. Sekino,K. Niihara, Langmuir 14, 3160 (1998).
10)T. Kasuga, M. Hiramatsu, A. Hoson, T. Sekino, K. Niihara, Adv. Mater. 11, 1307 (1999).
11)Q. Chen, G. H. Du, S. Zhang, L. M. Peng, Acta Crystallogr. B, 58, 587 (2002).
12)R. Ma, Y. Bando, T. Sasaki, Chem. Phys. Lett., 380, 577 (2003).
13)X. Wang, Y. Li, Chem. Lett., 33, 48 (2004).
14)A.-W. Xu, Y.-P. Fang, L.-P. You, H.-Q. Liu, J. Am.Chem. Soc., 125, 1494 (2003).
15)Y.-P. Fang, A.-W. Xu, L.-P. You, R.-Q. Song, J.C. Yu, H.-X. Zhang, Q. Li, H.-Q. Liu, Advanced Functional Mater., 13, 955 (2003).
16)Q. Tang, J. Shen, W. Zhou, W. Zhang, W. Yu, Y. Qian, J. Mater. Chem., 13, 3103 (2003).
17)C. Guo, M. Cao, C. Hu, J. Nanosci. Nanotechnol., 5, 184 (2005).
18)Q. Tang, Z. Liu, S. Li, S. Zhang, X. Liu, Y. Qian, J. Crystal Growth, 259, 208 (2003).
19)M. Yada, C. Taniguchi, T. Torikai, T. Watari, S. Furuta, H. Katsuki, Advanced Mater., 16, 1448 (2004).
20)W. Li, X. Wang, Y. Li, Chem. Commun., 164 (2004).
21)H.-J. Muhr, F. Krumeich, U. P. Schonholzer, F. Bieri, M. Niederberger, L. J. Gauckler, J. Ludwig, R. Nesper, Advanced Mater., 12, 231 (2000).
22)X. Chen, X. Sun, Y. Li, Inorg. Chem., 41, 4524 (2002).
23)G. T. Chandrappa, N. Steunou, S. Cassaignon, C. Bauvais, J. Livage, Catalysis Today, 78, 85 (2003).
24)W. Chen, J. Peng, L. Mai, Q. Zhu, Q. Xu, Mater. Lett., 58, 2275 (2004).
25)Y. Mao, S. Banerjee, S. S. Wong, Chem. Commun., 408 (2003).
26)N. P. Padture, X. Wei, J. Am. Ceram. Soc., 86, 2215 (2003).
27)Y. Tian, Y. He, Y. Zhu, Mater. Chem. Phys., 87, 87(2004).
28)H. A. Therese, J. Li, U. Kolb, W. Tremel, Solid State Sci., 7, 67 (2005).
29)B. Mayers, Y. Xia, Adv. Mater., 14, 279 (2002).
30)Y, Li, J. Wang, Z, Deng, Y. Wu, X. Sun, D. Yu, P. Yang, J. Am. Chem. Soc., 123, 9904 (2001).
31)M. Cao, C. Hu, Y. Wang, Y. Guo, C. Guo, E. Wang, Chem. Commun., 1884 (2003).
32)H. Zhang, D. Yang, Y. Ji, X. Ma, J. Xu, D. Que, J. Phys.Chem. B, 108, 1179 (2004).
33)黒田一幸,セラミックス,36,902(2001).
34)T. Yanagisawa, T. Shimizu, K. Kuroda, C. Kato, Bull. Chem. Soc. Jpn., 63, 988 (1990).
35)C. T. Kresga, M. E. Leonowicz, W. J. Roth, J. C. Vartuli, J. S. Beck, Nature, 359, 710 (1992).
36)J. S. Beck, J. C. Vartuli, W. J. Roth, M. E. Leonowicz, C. T. Kresga, K. D. Schmitt., C. T-W. Chu, D. H. Olson, E. W. Sheppard, S. B. McCullen, J. B. Higgins, J. L. Schlenker, J. Am. Chem. Soc., 114, 10834 (1992).
37)例えば,“メソポーラス物質の新展開”,セラミックス,36,(2001)p902.
'Material' 카테고리의 다른 글
| (Nickel paste) 니켈 입자와의 균일 혼합 기술의 개발 (0) | 2021.07.24 |
|---|---|
| (Nickel powder) Improved Nickel Powder for Small Case Size MLCC with High Capacitance (0) | 2021.07.24 |
| (C0G MLCC) 환원분위기에서 소성한 (CaSr)(TiZr)O3계 유전체의 저주파 유전 분산 (0) | 2021.05.01 |
| (Paste)잉크제조법과 생산기술 (0) | 2021.04.03 |
| (Paste)용제계에서의 안료분산 (0) | 2021.04.03 |