(Dispersion) 세라믹 입자의 분산
Principles of Ceramics Processing, J.S. Reed
1. Solvents (Liquids)
Ceramic processing에 있어 액체들은 세라믹 입자들을 적시고 그들 사이의 점성 매체를 제공하며, 계 안의 염, 화합물 및 중합체 물질을 용해시키기 위하여 사용된다.
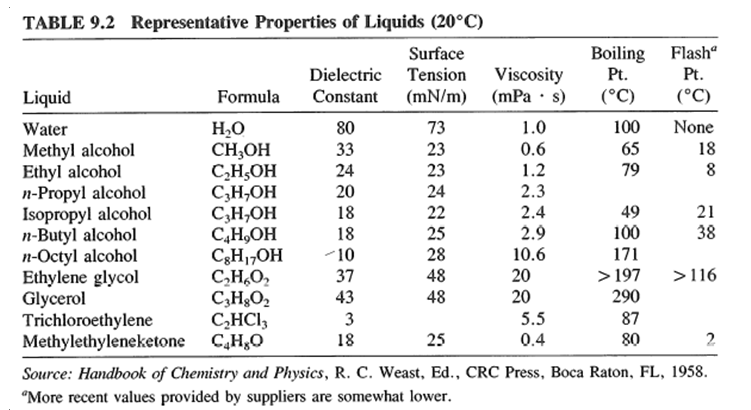
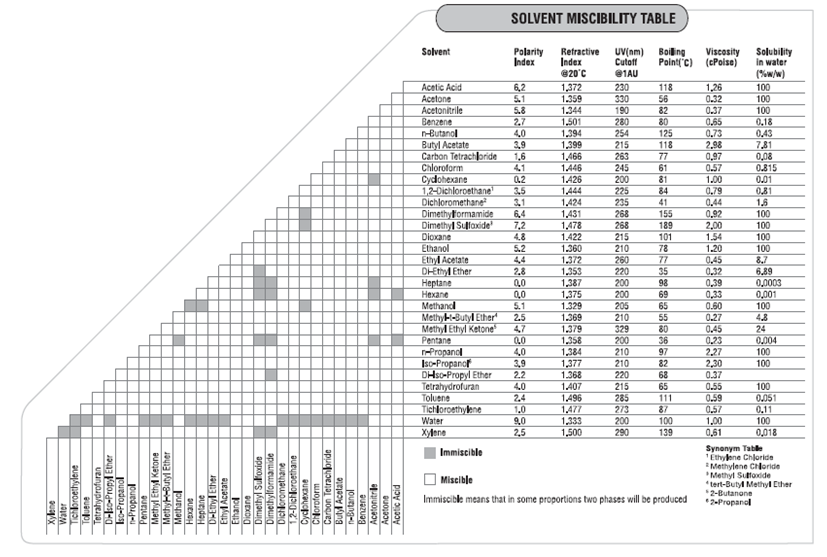

Hildebrand Solubility Parameters
Standard Hildebrand values from Hansen, Journal of Paint Technology Vol. 39, No. 505, Feb 1967
SI Hildebrand values from Barton, Handbook of Solubility Parameters, CRC Press, 1983
Values in parenthesis from Crowley, et al., Journal of Paint Technology Vol. 38, No. 496, May 1966

2. Polar Liquids near Oxide Surfaces
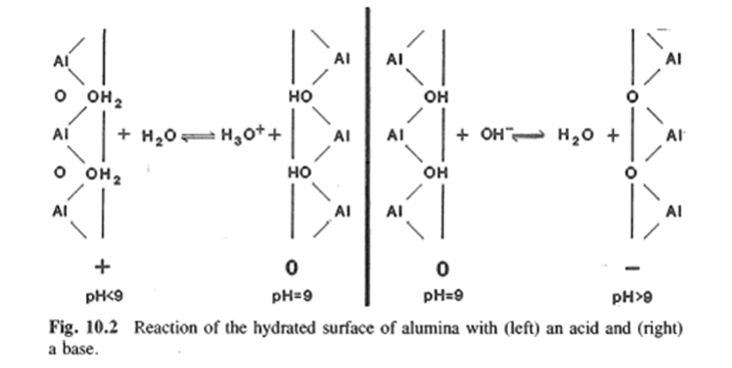
극성 액체는 분산된 산화물 입자의 표면에 물리적 및 화학적으로 흡착될 수 있다. 물에서 SiO2, Al2O3, 및 TiO2와 같은 산화물에 대하여, 화학적 표면 수화의 증거가 IR, heats of immersion 및 흡착-탈착 속도론의 열적 거동에 의하여 제공된다. 따라서 다음 형태의 반응들이 제안되었다 (아래 Fig. 9.1 참조).

이러한 금속산화물 표면의 극성 수산기 (-OH)는 물분자들을 표면으로 끌어당기고, 여러 층의 물리적 흡착층을 형성시킨다. 이렇게 물리적으로 흡착된 물분자들은 움직이지 못하여 bulk 상태의 물과는 다른 구조를 하고 있다. 흡착 거동은 표면의 열적 이력과 수화에 크게 의존한다.

3. 액체 현탁액 (suspension) 안에서 입자의 하전
3.1 액체에서 세라믹 입자 표면 하전 (charge)의 기원 (origin)
(1) 재료 표면에서 이온들의 탈착
(2) 표면의 조성을 변화시키는 표면과 액체 매체 사이의 화학반응
(3) 입자에 인접한 화학 용액으로부터 특정한 첨가제 또는 불순물 이온들의 선택적인 흡착
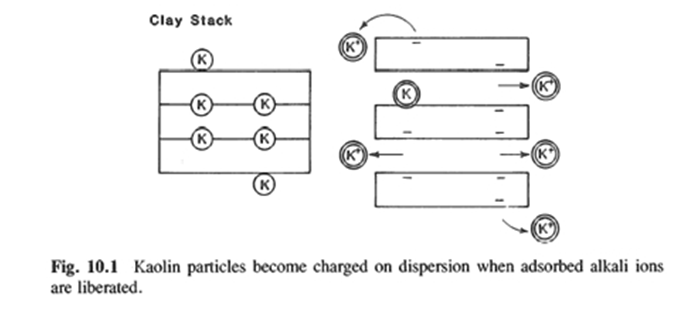
(1) 탈착 (Desorption) 과 용해 (Dissolving)
Kaolin은 알칼리 금속을 물 안으로 유리시키며, Fig.10.1과 같이 음으로 하전된 입자의 표면을 남긴다.
(2) 수성 매체와의 화학반응
수화된 표면을 가진 산화물에 대하여, 물 안에서 표면화학은 다음의 화학 반응에 의해 지배된다.
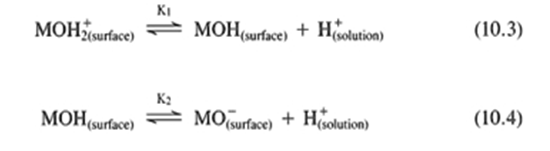
여기서, M은 Ba2+, Al3+, Si4+, Ti4+, Zr4+ 등과 같은 표면의 금속 이온을 나타낸다. 각 M은 결합 요구를 만족시키기 위하여 내부의 산소 이온과 역시 결합되어 있다. 표면의 영 전하점 PZC (point of zero charge) 는 반응식 (10.3)과 (10.4)의 pK 들의 항으로 정의된다.

그리고 이것은 표면의 평균 산-염기 특성을 나타낸다. 표면의 수산기가 4가 양이온에 결합될 때, 더욱 산성이며, PZC는 더 낮아진다. 여러 요업 재료의 대략적인 PZC 값이 표 10-1에 수록되어 있다.

Fig.10.2의 알루미나에 대해 나타내었듯이, 물 안에 분산된 순수 산화물 입자의 수화된 표면의 전하는 H3O+ 또는 OH- 와의 반응에 의해 결정된다. H3O+ 이온의 첨가는 pH를 감소시킬 것이며 하전되지 않은 표면이 양성자를 받아서 양으로 하전하게 된다. OH- 이온 첨가는 표면으로부터 수소를 제거하여 pH가 표면의 PZC 보다 더 클 때 음의 표면전하를 만들 것이다. 표면에서 교환은 가역적이나 시간 의존적이며, OH- 또는 H3O+ 이온의 상대적 농도가 포텐셜을 결정한다. 일반적으로, 입자의 용해 속도는 PZC에서 최소가 된다.
(3) 특수 이온의 흡착
순수한 액체 매체의 성분이 아닌 용액 내의 이온들은 역시 표면과 상호작용한다. 단순한 이온들은 반대로 하전된 표면에 흡착된다. 단순한 이온들 M+ 또는 A-의 완전한 흡착은 다음 반응에 의해 나타내었듯이 표면 전하를 중성화시킬 수 있다.

피로인산 소다 (sodium pyrophosphate)와 같은 착이온들은 중성 표면에 혹은 하전된 표면에 흡착될 수 있다 (Fig.10.5). 다원자가의 흡착은 표면 전하를 역전시킬 수 있다

4. 전기 이중층 (Electric Double-Layer)
입자를 둘러 싸고 있는 용액 내에서 이온과 극성 분자들에 의하여 표면은 하전된다. 쿨롱력은 같은 전하의 이온들을 반발하게 하나 극성 액체 분자들과 반대로 하전된 이온들을 표면 근처로 당기며, bulk농도에 비하여 그들의 농도를 증가시킨다. 비교적 부동의 반대이온에 의한 흡착층 (adsorbed layer, or Stern layer)과 정상 상태 (steady-state) 배열에 도달하기 까지의 확산층 (diffuse layer) 내에는 반대이온과 극성 액체 분자들의 농도 기울기를 지닌 하전된 입자로 이루어진 층이다. 이 모델은 현재 확산 전기이중층 모델 (diffuse electrical double-layer model)이라고 보통 부른다.

Gouy와 Chapman은 균일하게 하전된 표면, 균일한 유전상수 εr 를 가진 인접 용액 및 점 전하에 기초한 확산 이중층 안에서 포텐셜 기울기에 대한 모델을 서로 독립적으로 유도하였다. 전하 분포가 Boltzman 식에 의하여 기술된다고 가정하면, 표면 위에 흡착된 농도 Ni 에 비하여 확산층 안의 반대 이온의 농도 Nio는 다음과 같다
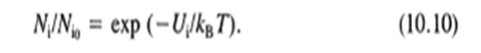
이온의 포텐셜 에터지 Ui 는 이온의 원자가 Zi 와 그 위치에서의 전기적 포텐셜 Ψ 의 함수이다

표면 포텐셜 Ψ0 ≤ 100 mV인 경우에,

여기서 κ^-1 은 하전된 표면으로부터 Ψ = Ψ0 / 2.718 인 면까지의 거리이며, 전기이중층 두께라고 부른다. 이중층 두께는 다음 식으로부터 계산된다.

여기서 Ni 는 용액상 안에서 각 이온 형태의 농도이고, F는 Faraday 상수이다. Gouy-Chapman 모델에 의해 예측된 위치에 따른 포텐셜의 변화가 Fig.10.7에 나타나 있다. 20℃에서 1:1 전해질의 0.01M 수용액에 대하여, 유효 이중층 두께 κ-1 은 약 3 nm로 계산된다. 반대이온의 농도 또는 원자가의 증가는 이중층을 압축시키고 포텐셜 기울기를 증가시킨다. 더 낮은 유전 상수 또는 낮은 온도의 액체 사용은 역시 이중충을 압축시킨다.